
Contenu
La sécurité des patient·es
Un traitement doit être le plus efficace et le plus sûr possible. Mais aucun médicament n’est totalement dépourvu de risques. Toutefois, seuls les médicaments dont les avantages l'emportent sur les risques sont utilisés. Fabricants et autorités déploient de grands efforts pour connaître dans le détail les risques potentiels d’un médicament et les réduire au maximum. Un médicament est ainsi soumis à de nombreuses évaluations avant d’obtenir une autorisation de mise sur le marché. De quelles étapes s’agit-il et comment pouvez-vous, en tant que personne concernée, y contribuer? Autant de questions auquel cet article propose de répondre.
Le parcours vers des médicaments sûrs
La priorité numéro 1 est d’assurer la sécurité des patient·es. C’est pourquoi les médicaments ne sont autorisés à la vente que lorsqu’ils sont non seulement efficaces, mais aussi sûrs. Même après leur mise sur le marché, la sécurité des médicaments continue d’être surveillée.
Tous les médicaments sont susceptibles de provoquer des effets indésirables – ou effets secondaires – tels que des maux de tête ou des nausées, en marge des effets thérapeutiques souhaités. Malheureusement, aucun médicament n’est totalement sans risque. Mais il est déterminant que le bénéfice d’un médicament soit nettement supérieur au(x) risque(s) qu’il fait courir. Seuls des médicaments présentant un rapport bénéfice-risque positif sont autorisés à la prescription. Ils ne resteront sur le marché que tant que ce rapport est garanti.
Pour qu’un médicament offre aux patient·es la meilleure sécurité possible, il est examiné et surveillé de près pendant toutes ses «phases de vie».
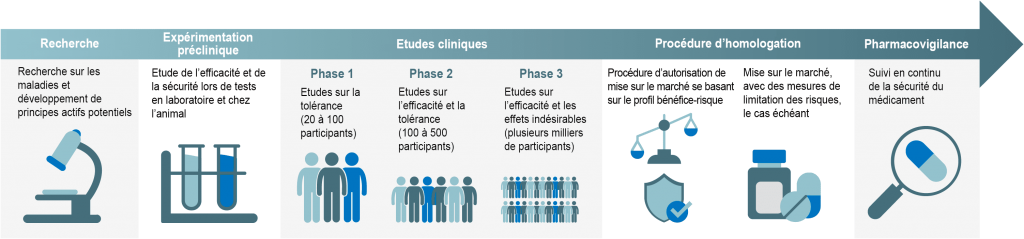
Avant l’autorisation: recherches en laboratoire et études
Un nouveau médicament est le fruit de plusieurs années de recherche et développement. Le principe de sécurité intervient très tôt dans ce processus et y joue un rôle majeur. Bien avant d’être utilisé sur les êtres humains, un principe actif est d’abord testé de manière intensive en tubes à essai, en cultures cellulaires et sur des animaux. Les personnes en charge du développement contrôlent notamment si son utilisation peut être toxique à court ou long terme, déterminent la dose optimale, étudient comment le principe actif est métabolisé dans l’organisme et s’il a une influence sur la fertilité ou le développement embryonnaire.
Beaucoup de principes actifs potentiels sont exclus dès cette phase de développement précoce, les tests montrant qu’ils ne sont pas assez sûrs. Seules les substances qui font leurs preuves peuvent ensuite être testées sur l’être humain. Ce que l’on appelle les essais cliniques (ou études cliniques) durent généralement plusieurs années. Ils se déroulent selon trois phases, le nombre de participant·es augmentant de phase en phase. La phase 3, dernière étape de l’essai clinique, inclut ainsi plusieurs milliers, voire plusieurs dizaines de milliers de patient·es. Il s’agit non seulement de prouver l’efficacité du médicament, mais aussi d’en savoir plus sur son profil de sécurité et sur ses effets secondaires.
Les études cliniques sont un cap important à franchir pour les médicaments potentiels. Beaucoup de principes actifs-candidats ne sont pas retenus, pour de multiples raisons. Souvent, c’est l’efficacité qui est insuffisante. D’autres fois, il survient des effets indésirables chez l’humain qui n’avaient pas été détectés chez l’animal et pèsent trop lourd par rapport à l’efficacité. Seuls les médicaments qui ont passé avec succès toutes les phases de l’essai clinique sont autorisés par les autorités compétentes à être utilisés dans la pratique.
L’autorisation par les autorités compétentes en produits thérapeutiques
L’Institut suisse des produits thérapeutiques, Swissmedic, examine avec soin chaque demande d’autorisation de médicament. Il analyse toutes les données collectées par l’étude et décide si le médicament est sûr et efficace. Swissmedic détermine également quelles mesures doivent être mises en place pour minimiser le plus possible les risques identifiés.
Les mesures importantes pour augmenter la sécurité des patient·es peuvent varier énormément selon le produit thérapeutique. Voici quelques exemples:
- Certains médicaments ne peuvent être délivrés que sur prescription médicale (ordonnance obligatoire)
- Des informations précises sur les risques sont mises à la disposition du personnel médical et des patient·es (par ex. via la notice)
- Les médecins qui prescrivent le médicament doivent s’assurer régulièrement de la sécurité de leurs patient·es par des examens sanguins ou d’autres analyses.
- Les patient·es se voient remettre des supports d’information, une carte de suivi ou des instructions spécifiques avec des informations importantes sur leur traitement.
Supposons que la prise d’un médicament X puisse être dangereuse pour l’enfant à venir lors d’une grossesse. Pour diminuer le risque, la notice stipulerait qu’une méthode de contraception fiable doit être utilisée tout au long du traitement. De plus, le médicament X ne serait disponible que sur ordonnance, c’est-à-dire uniquement sur prescription médicale.
La procédure qui va du dépôt de la demande d’autorisation à la décision prise par Swissmedic dure généralement plus d’un an. Mais cet examen minutieux selon des directives strictes en vaut la peine. Il veille à ce que seuls des médicaments suffisamment sûrs arrivent sur le marché suisse. C’est seulement après une décision d’autorisation positive par Swissmedic que les médecins peuvent prescrire un médicament à des fins thérapeutiques.
Les médicaments ne sont autorisés que si leur sécurité est vérifiée de façon approfondie et que leur bénéfice est supérieur aux risques.
Contenu
Après l’autorisation de mise sur le marché: la pharmacovigilance
Même après l’autorisation et la mise sur le marché, les fabricants de produits pharmaceutiques doivent constamment surveiller la sécurité de chacun de leurs médicaments. Ce processus s’appelle la pharmacovigilance et se déroule en étroite collaboration avec Swissmedic, l’Institut suisse des produits thérapeutiques. Par pharmacovigilance, on désigne toutes les mesures ayant pour objectif de surveiller, d’évaluer et de comprendre tous les effets indésirables du médicament pour aider à les prévenir.
Parmi ces mesures, on trouve par exemple l’obligation pour les médecins et les pharmacien·nes de signaler des effets indésirables graves ou inconnus. Ces signalements dits spontanés sont un élément important de la pharmacovigilance. Ils peuvent venir du personnel médical, mais aussi directement des patient·es. De plus, de nouvelles études et analyses ciblées sont parfois menées après l’autorisation de mise sur le marché afin d’en apprendre davantage sur la sécurité d’un médicament utilisé quotidiennement.
Pourquoi la recherche sur la sécurité d’un médicament continue-t-elle après la mise sur le marché, si les médicaments autorisés ont tous fait l’objet de contrôle?
Cette question est légitime. La raison pour laquelle un suivi continu de la sécurité est assuré est la suivante: même des essais de grande ampleur ne permettent pas de garantir que tous les effets indésirables seront repérés. Certes, la plupart des effets secondaires sont identifiés au cours des essais cliniques, mais il peut arriver que l’on passe à côté d’effets secondaires rares. Enfin, le groupe des participant·es à l’étude – aussi vaste soit-il – ne reste toujours qu’un échantillon. L’efficacité des médicaments peut varier d’une personne à l’autre. De plus, certains effets secondaires ne surviennent qu’après une très longue durée de traitement et sont donc difficiles à identifier lors d’études cliniques réalisées sur une période limitée. Ce sont quelques-unes des raisons qui justifient le suivi des médicaments après leur autorisation de mise sur le marché.
Les mesures pour garantir la sécurité d’un médicament n’ont pas toujours été aussi importantes qu’aujourd’hui. Certains incidents tragiques sont ainsi survenus par le passé, attirant l’attention sur l’importance de la pharmacovigilance et d’une réglementation stricte des autorisations de mise sur le marché des médicaments.
Par exemple, dans les années 1950, un certain somnifère était disponible sans ordonnance. Lors de sa mise sur le marché, il était considéré comme présentant peu de risques et était même prescrit à des femmes enceintes. Comme il n’y avait alors que peu de directives encadrant l’étude et le suivi de la sécurité des médicaments, on vérifiait rarement si le principe actif pouvait nuire à l’enfant en gestation. La loi ne prévoyait pas non plus de pharmacovigilance pour surveiller le médicament après l’autorisation de mise sur le marché.
On n’a donc découvert que bien des années après que ce médicament pouvait entraîner des malformations chez l’enfant à naître, lorsque la femme enceinte le prenait pendant certaines semaines de sa grossesse. Quand ce lien de cause à effet a été établi, en 1961, le somnifère a immédiatement été retiré du marché et les directives encadrant le développement et l’autorisation des médicaments ont été largement renforcées. Depuis, la sécurité d’un nouveau médicament doit impérativement être appuyée sur des preuves détaillées.
Mais ces exigences auraient-elles suffi à éviter la tragédie évoquée plus haut? Pour répondre à cette question, le principe actif du somnifère a été soumis, à la fin des années 1960, aux tests de sécurité devenus obligatoires entre temps. Il s’est avéré que les examens auraient indiqué de manière fiable les risques présentés par la substance pour le développement de l’embryon. Si le principe actif avait été découvert plus tard, alors l’autorisation pour la mise sur le marché du somnifère n’aurait certainement pas été validée. Un médicament avec un tel profil de risques n’entre en ligne de compte – dans le meilleur des cas – que pour le traitement d’une maladie grave et ne répondant à aucun autre traitement, sous contraception stricte et prescription médicale.
L’incident relaté plus haut a été l’élément déclencheur qui a abouti à la mise en place de systèmes de pharmacovigilance dans le monde entier. C’était, en d’autres termes, «les premières heures» de la pharmacovigilance qui permet aujourd’hui d’identifier suffisamment tôt de nouveaux effets indésirables pour un médicament et de prendre rapidement les mesures correspondantes.
Même après l’autorisation de mise sur le marché des médicaments, il faut constamment vérifier leur tolérance pour garantir la sécurité des patient·es. Les patient·es peuvent y contribuer en signalant d’éventuels effets secondaires.
Contenu
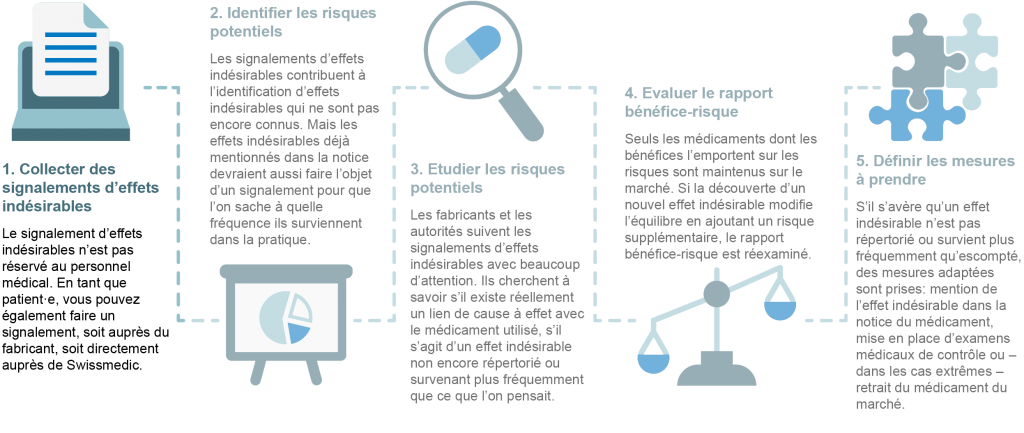
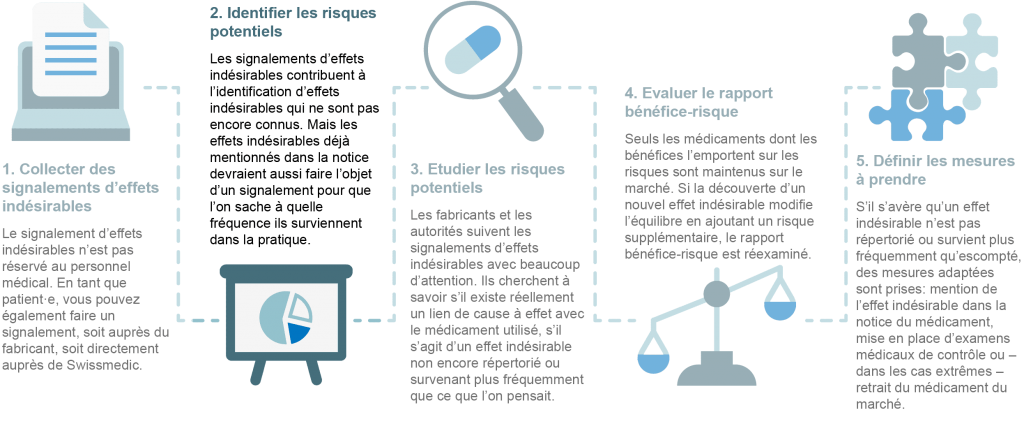
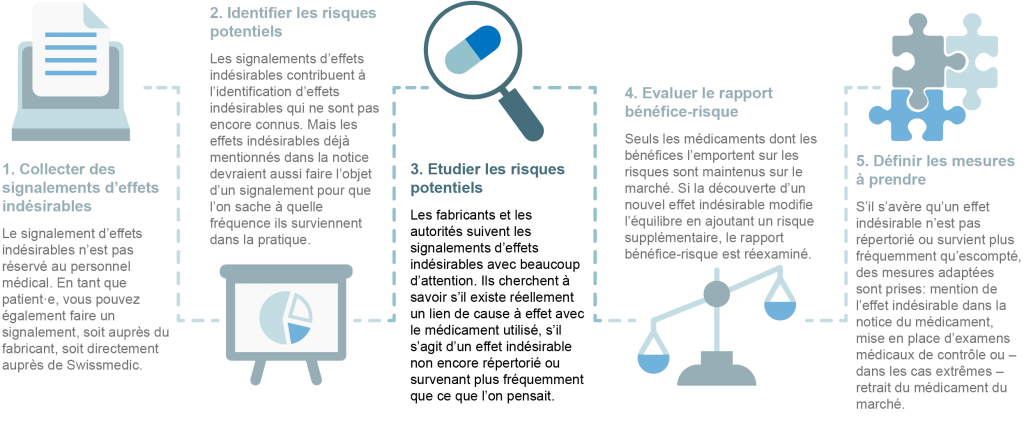
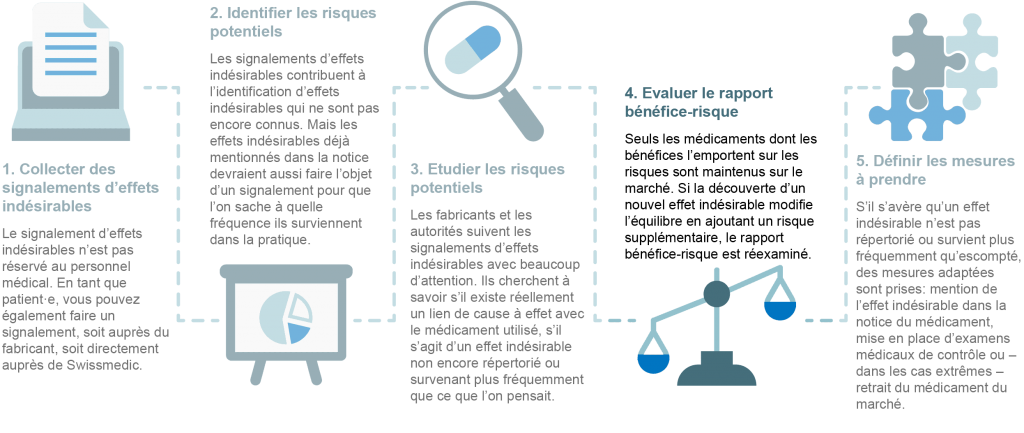
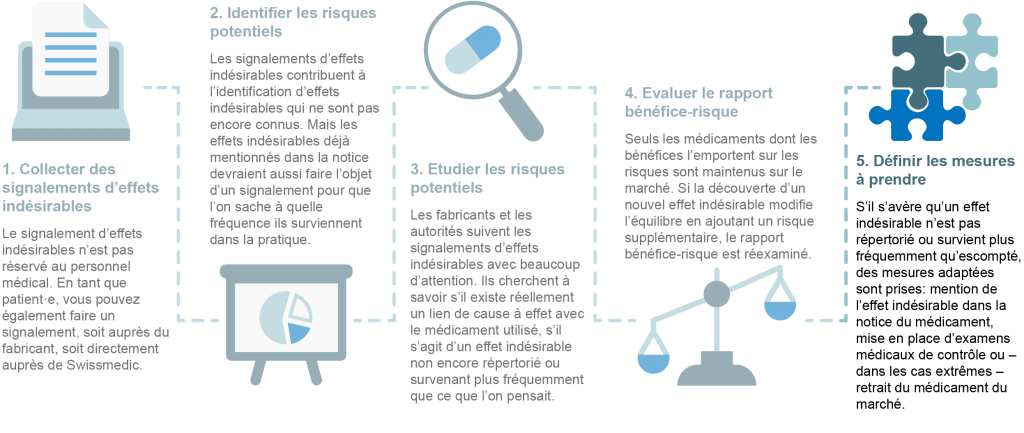
Comment sont traités les signalements d’effet indésirable?
Pour surveiller en continu la sécurité des médicaments, les fabricants sont informés des signalements d’effets secondaires par le personnel médical ou par les patient·es. Tous les signalements sont anonymisés et analysés par les fabricants et les autorités compétentes pour déterminer l’existence de nouveaux risques. Dans la mesure où les médicaments sont utilisés partout dans le monde, la sécurité des médicaments est une affaire internationale. C’est pourquoi tous les cas suspects signalés sont également recensés par la base de données de l’OMS, l’Organisation Mondiale de la Santé.
La sécurité d’un médicament est ainsi évaluée de façon continue par différentes instances. Si cette évaluation met en lumière une évolution du rapport bénéfice-risque, les autorités compétentes et les fabricants en sont aussitôt informés pour qu’ils puissent prendre les mesures nécessaires. Les mesures peuvent être les suivantes:
- Un nouvel effet indésirable ou une nouvelle mise en garde est ajouté(e) aux informations professionnelles (pour les médecins) et à la notice (pour les patient·es).
- Des supports d’information sont rédigés à l’intention des médecins et/ou des patient·es.
- Des examens de contrôle médical supplémentaires sont mis en place.
- L’utilisation du médicament est limitée pour certains groupes de personnes (par ex. les femmes enceintes) ou en cas de traitement concomitant avec d’autres médicaments.
- Dans le cas le plus grave, le médicament est retiré du marché à cause des nouveaux risques découverts. Heureusement, dans la pratique, on n’en arrive que très rarement à des mesures aussi drastiques. En effet, les risques découverts après l’autorisation de mise sur le marché peuvent généralement être contrés avec les mesures décrites ci-dessus.
Comment bien prendre en charge les effets secondaires
Quand vous utilisez un médicament, il est important de savoir ce qu’il faut faire en cas d’éventuels effets secondaires. Pour cela, il faut comprendre ce que sont précisément les effets secondaires.
La plupart du temps, les médicaments agissent sur différentes parties de l’organisme et peuvent ainsi provoquer différents résultats. Outre les effets souhaités, on compte malheureusement aussi parfois des effets indésirables. Ces effets non voulus du médicament sont appelés effets secondaires.
Certains effets secondaires sont d’ordre physique, par exemple des éruptions cutanées ou de la tachycardie. Mais ils peuvent également impacter le psychisme en provoquant, par exemple, des cauchemars. Tant que les effets secondaires restent légers, ils passent souvent inaperçus pour les patient·es. Mais ils peuvent aussi provoquer des troubles importants et même être dangereux pour la personne traitée.
Tous les troubles qui apparaissent pendant le traitement ne sont pas liés au médicament prescrit. Il peut s’agir de symptômes de la maladie même ou d’un problème ayant une autre raison. C’est pourquoi il est important de parler avec votre médecin des symptômes nouveaux ou inhabituels que vous constatez.
Si vous pensez ressentir des effets secondaires, parlez-en toujours avec le personnel médical.
Contenu
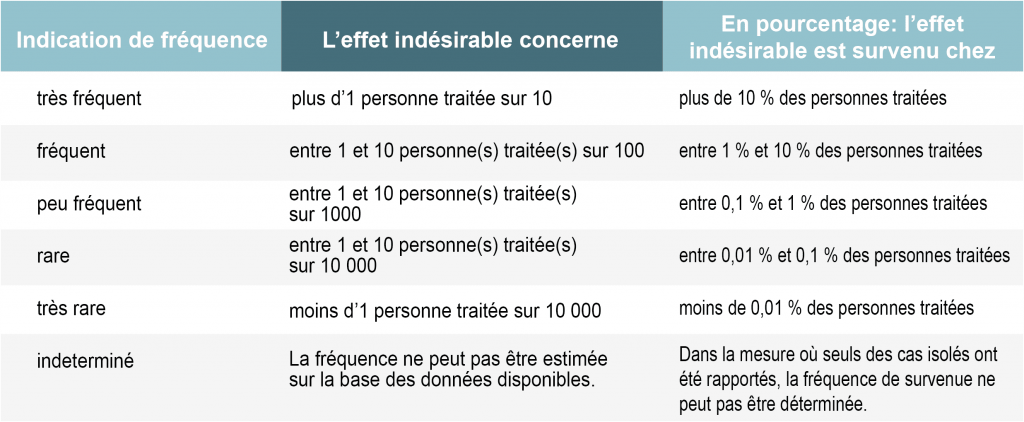
A quelle fréquence apparaissent les effets secondaires
La notice (si elle est fournie avec le produit) énumère les effets secondaires connus d’un médicament. Il est important de noter que tous les effets secondaires n’apparaissent pas chez toutes les personnes traitées. Bien au contraire. La plupart des effets secondaires ne surviennent que chez une petite minorité de personnes traitées. En règle générale, si des effets secondaires surviennent, le patient n’en développe que quelques-uns et non tous ceux présents sur la liste. Pour chaque effet secondaire, la notice indique la fréquence, c’est-à-dire le nombre moyen d’utilisateurs touchés par cet effet secondaire, selon l’échelle suivante:
Que faire en cas d’effets secondaires
Veillez aux effets secondaires et parlez-en avec votre médecin.
Souvent, les patient·es cessent de suivre les instructions de leur médecin, voire interrompent leur traitement à cause des effets secondaires. Interrompre un traitement en cours sans en parler avec les personnes compétentes peut entraîner des risques sérieux. D’autant que les effets secondaires peuvent souvent être traités de façon ciblée et les symptômes atténués. Il est donc essentiel de veiller aux effets secondaires et de les signaler aux personnes compétentes. Notez tous les effets secondaires que vous remarquez et discutez-en lors de votre prochaine visite avec votre médecin. Ensemble, vous pouvez traiter les troubles ou envisager de changer le traitement. Si vous souffrez de graves effets secondaires, alors n’attendez pas pour contacter votre médecin.
Signalez les effets secondaires
En signalant les effets secondaires, vous pouvez contribuer à l’identification et la recherche sur des effets secondaires inconnus ou décrits de façon insuffisante.
Comment signaler des effets secondaires
Les patient·es peuvent aussi signaler des effets secondaires et participer à l’amélioration de la qualité et de la sécurité des médicaments.
Signaler des effets secondaires
Les effets secondaires de tous les médicaments peuvent être signalés à Swissmedic via ce formulaire. Vous pouvez aussi utiliser ce formulaire Roche pour signaler des effets secondaires concernant des produits Roche.
Important: discutez toujours des effets secondaires que vous ressentez avec votre médecin pour traiter les troubles ou envisager de changer le traitement.
Les informations suivantes sont requises pour un signalement d’effet secondaire:
- Informations sur la personne qui signale et la personne concernée par les effets (s’il ne s’agit pas de la même personne)
- Nom du médicament
- Type d’effet secondaire ou de trouble
- Plus vous donnez d’informations (par ex. les médicaments concomitants, la dose ou le numéro de lot du médicament) sur l’effet secondaire, mieux votre signalement peut être pris en compte.
Il est possible que la personne qui traite votre signalement vous contacte pour vous poser des questions et évaluer plus précisément votre signalement.
Comment rendre votre traitement plus sûr
En tant que patient·e, vous pouvez aussi contribuer à améliorer la sécurité et la tolérance de votre traitement. Le plus important est de participer activement et de communiquer vos avis sur votre traitement. Cela peut se révéler être très positif sur le résultat de votre traitement. Voici les principes à suivre:
- Posez des questions quand vous ne comprenez pas quelque chose ou quand quelque chose vous préoccupe.
- Tenez vos documents à jour, notamment une liste de tous les médicaments que vous prenez et apportez-la pour la consultation.
- Impliquez activement les membres de votre famille ou les personnes qui vous accompagnent. Ces personnes peuvent vous soutenir émotionnellement et vous aider en écoutant et en réfléchissant à vos côtés.
Vous pouvez grandement contribuer à la sécurité de votre traitement en communiquant activement et en demandant des réponses à toutes vos questions.
Contenu
Vous trouverez ci-dessous des conseils pour vous aider à contribuer à la réussite de votre traitement et à votre sécurité. Vous pouvez télécharger ces conseils également en pdf et les utiliser comme checklist pendant votre traitement.
Pour de plus amples informations sur le thème «La sécurité des médicaments», vous trouverez → ici une brochure informative de la Fondation Sécurité des patients Suisse, que vous pouvez également commander en version papier via ce → site Internet.
Checklist: conseils pour la sécurité de votre traitement
Avant la visite médicale
- Notez toutes vos questions avant votre consultation médicale et prenez-les avec vous au moment du rendez-vous.
- Apportez tous les documents nécessaires à votre rendez-vous médical:
- Votre → schéma thérapeutique actuel avec tous les médicaments mais aussi tous les produits à base de plante et les compléments alimentaires en accès libre
- Votre carnet de santé (carte-patient, pass thérapeutique, pass vaccinal, etc.)
- Tous les rapports d’analyse importants provenant d’autres médecins.
- L’idéal est de demander à une personne de votre entourage de vous accompagner pour être à vos côtés lors du rendez-vous médical (particulièrement important s’il y a la barrière de la langue).
Pendant la visite médicale
- Voici les points importants à évoquer avec votre médecin au cours de l’entretien :
- Vous êtes enceinte ou avez l’intention de l’être bientôt, ou vous allaitez.
- Vos affections (même celles qui sont traitées par un autre médecin)
- Dites à votre médecin quels autres médicaments vous prenez (à l’aide de votre schéma thérapeutique) et faites-en vérifier la pertinence.
- Vos allergies (notamment à des principes actifs précis) et intolérances connues
- Les effets secondaires, rencontrés pendant le traitement
- Posez toutes vos questions lors de l’entretien avec votre médecin :
- Si vous n’avez pas compris quelque chose, demandez des explications. N’ayez pas peur de poser plusieurs fois la ou les question(s) si vous avez besoin.
- Cela peut aider de répéter ce que vous avez compris avec vos propres mots pour vérifier que vous avez tout bien compris.
- Faites-vous expliquer à quoi servent les médicaments que vous recevez. Posez des questions sur les risques et les effets secondaires d’un traitement et demandez si les médicaments que vous prenez sont compatibles entre eux.
- Faites-vous expliquer par votre médecin les résultats d’analyse et les propositions de traitement.
- Demandez qu’on vous précise à quoi vous devez prêter attention et ce que vous pouvez faire pour assurer le succès du traitement.
- Prenez des notes lors de l’entretien avec le médecin.
- Assurez-vous d’avoir compris exactement comment prendre les médicaments.
- S’il vous semble qu’il y a eu une confusion concernant le traitement, parlez-en au personnel de santé.
- Demandez un schéma thérapeutique avec des indications précises sur la prise des médicaments.
Après la visite médicale
- Vérifiez que la pharmacie vous délivre les bons médicaments.
- Surveillez-vous, notez les effets secondaires supposés et parlez-en à votre médecin. Si vous craignez de souffrir d’un effet secondaire grave, prenez contact sans attendre avec votre médecin.
- Lisez attentivement la documentation que votre médecin vous donne.
- Suivez exactement les instructions pour la prise de vos médicaments.
- Manifestez-vous si vous attendez des résultats d’analyse.
- Allez à tous les rendez-vous pris dans le cadre de votre traitement ou d’analyses.
- En cas de décisions importantes ou d’intervention, parlez-en à vos proches.
→ Télécharger la checkliste
Tout au long de leurs «phases de vie», les médicaments sont étroitement surveillés et examinés afin d’offrir la meilleure sécurité possible.
