
Contenu
Tester
Pourquoi est-il important de connaître la tumeur aussi précisément que possible ?
Chaque patient cancéreux est unique. Cela vaut non seulement pour leur personnalité, mais aussi pour leur affection cancéreuse : chaque cancer est différent. Les médecins établissent aujourd’hui un profil tumoral complet afin de caractériser précisément le cancer. Il est en effet possible de mettre au point un traitement ciblé si l’on caractérise précisément un cancer.
Le terme « cancer » est un diagnostic générique regroupant des maladies très diverses. Par exemple, le cancer de la prostate progresse souvent à un rythme si lent qu’il n’est pas nécessaire de le traiter et qu’il est préférable d’attendre. En revanche, d’autres formes de cancer connaissent une croissance rapide et agressive et ont, aujourd’hui encore, un mauvais pronostic.
Les cancers ne sont pourtant pas tous identiques, et ce même au sein d’un même organe. Dans le cas du cancer du sein, par exemple, il existe différents sous-types de cancer et chacun a son propre traitement. La classification du type de cancer se base ici sur les mutations ayant conduit à l’apparition du cancer. Ces dernières, appelées « biomarqueurs », peuvent être étudiées de manière précise à l’aide d’un test. Ces biomarqueurs permettent de créer un profil génomique spécifique pour chaque tumeur, ce qui permettra de planifier un traitement individualisé pour chaque patient.
Croissance naturelle
Notre corps est composé de milliards de cellules. Les cellules saines se multiplient en se divisant, comme par exemple lors de la cicatrisation des plaies ou de la croissance des cheveux. L’ADN et les gènes d’une cellule servent alors de guide de construction pour la création de ces nouvelles cellules. Ils régulent par ailleurs le processus de multiplication cellulaire et toute une série de signaux qui permettent d’éviter une croissance trop faible ou trop importante. Les modifications de l’ADN d’une cellule peuvent avoir de graves conséquences.
Tout commence avec l’adn de nos cellules
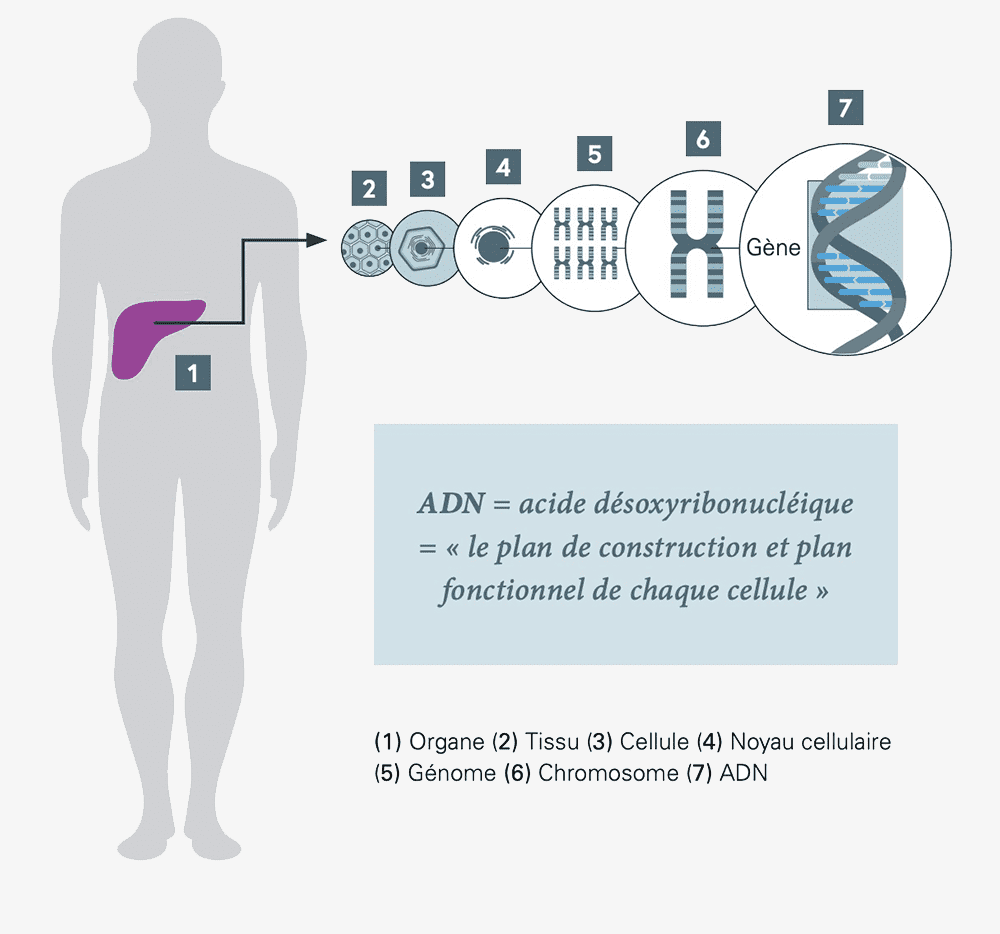
Les organes de notre corps se composent de différents tissus qui comportent des milliards de cellules. La cellule est la plus petite unité fonctionnelle du corps, et chaque cellule possède son noyau cellulaire.
Dans chaque noyau cellulaire se trouve une copie du génome. Un génome est l’ensemble de toutes les informations génétiques des cellules d’un être vivant. Il contient tous les gènes qui, eux-mêmes, sont composés de brins d’ADN, le plan de construction et plan fonctionnel de chaque cellule.
ADN : abréviation d’« acide désoxyribonucléique ». L’ADN contient les informations génétiques d’une cellule.
Gène : section d’ADN qui contient le plan de construction d’un produit génétique particulier, p. ex. une protéine.
Génome : désigne la totalité des informations héréditaires de la cellule.
Mutations génétiques à l’origine du cancer
Le tableau clinique d’un cancer n’est pas unique. Les cancers se présentent en effet sous les formes les plus diverses, mais ils possèdent une caractéristique commune : ils sont dus à des changements, appelés « mutations », qui se produisent dans notre patrimoine génétique – c’est-à-dire l’ADN et les gènes. Au début de la maladie, il est possible qu’une seule cellule du corps soit touchée. Cependant, les mutations entraînent des multiplications inhabituellement élevées de cette cellule, beaucoup plus importantes que dans le cas des cellules de l’organisme saines et exemptes de mutations. C’est ainsi qu’une tumeur peut se développer. Si une telle tumeur reste inaperçue pendant un certain temps, les cellules cancéreuses peuvent migrent vers d’autres parties du corps et y développer des métastases.
1) Une lésion de l’ADN d’une cellule peut transformer des cellules saines en cellules cancéreuses.
2) Plus rien alors ne freine leur prolifération et il se forme une tumeur.
3) Si cette dernière passe inaperçue pendant un certain temps, des métastases peuvent apparaître dans le corps.
Il n’est pas rare que des mutations se produisent dans les cellules de notre organisme. Des erreurs peuvent se produire lors de la division cellulaire, c’est-à-dire lorsque toutes les informations génétiques d’une cellule sont d’abord dupliquées puis réparties entre deux cellules filles. Lorsque ces erreurs se produisent dans un gène et que ce dernier est endommagé à cause de cette erreur, ce gène peut produire une protéine défectueuse qui n’est plus en mesure de remplir correctement sa fonction dans la cellule.
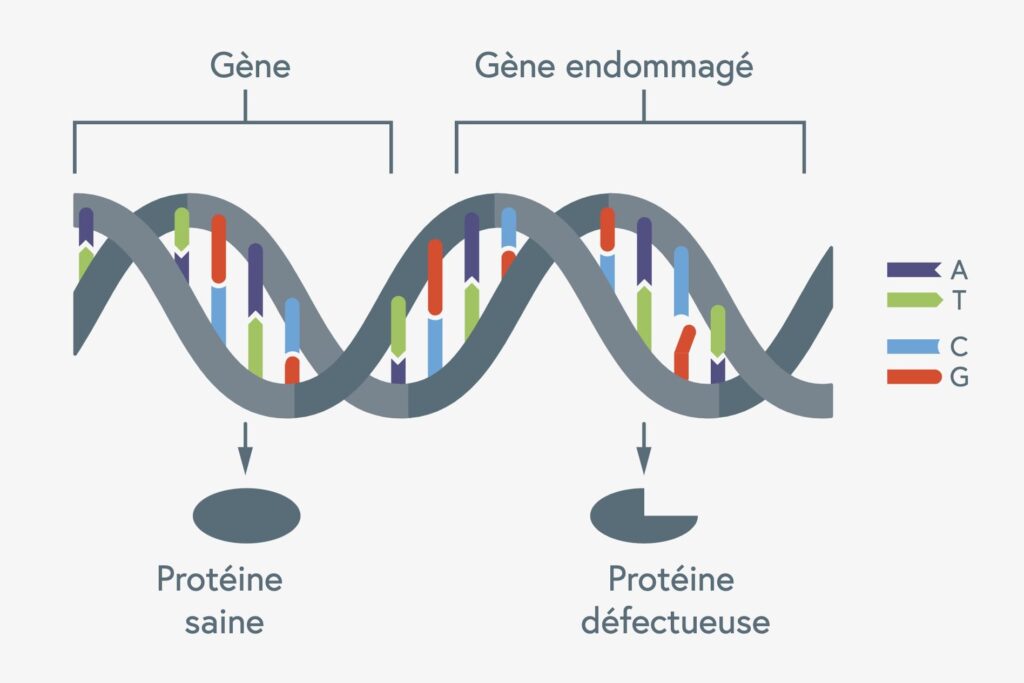
La forme de l’ADN rappelle celle d’une échelle de corde torsadée. Ses « échelons » sont formés par les quatre « bases » A, T, G et C, deux dans chaque cas dans un ordre différent. Celle-ci détermine à son tour l’information génétique.
Toutefois, dans la plupart des cas, ces mutations n’ont aucune conséquence sur la santé : soit parce que la modification est insignifiante, soit parce qu’elle est si grave que les cellules filles ne sont pas viables. Le système immunitaire peut également reconnaître la cellule mutée et l’éliminer. Dans de rares cas, la cellule mutante survit, elle est modifiée au point de devenir quasi « immortelle » et sa multiplication n’est plus contrôlée: il se forme alors une tumeur.
En règle générale, il n’est pas possible de savoir comment ou pourquoi une mutation s’est produite. Il est toutefois notoire que certains facteurs, comme le tabagisme ou la lumière solaire, augmentent le risque de mutations. En présence de ces facteurs, les changements génomiques sont en effet plus fréquents que d’habitude. Il existe parfois également une prédisposition génomique congénitale à certains types de cancer. Cela ne signifie pas pour autant que la maladie se déclarera systématiquement, mais les personnes concernées présentent un risque de cancer plus élevé que la moyenne de la population.
Plusieurs mutations sont souvent nécessaires pour que les cellules cancéreuses commencent à se développer de manière incontrôlée. Comme il existe des centaines de gènes différents responsables de la croissance cellulaire, d’innombrables mutations différentes peuvent être à l’origine d’un cancer. Nombre de ces mutations sont aujourd’hui étudiées et utilisées dans le développement de traitements anticancéreux, mais beaucoup d’autres doivent encore être mieux comprises.
Cancer et système immunitaire
La formation d’une tumeur à partir de cellules mutées dépend essentiellement de la capacité de notre système immunitaire à reconnaître ces cellules comme un danger potentiel et à les attaquer.
Fonctionnement du système immunitaire
Le système immunitaire est constitué de différentes cellules immunitaires spécialisées. Pour pouvoir combattre les agents pathogènes, les cellules de défense doivent faire la distinction entre « connu » et « inconnu ». Pour ce faire, elles reconnaissent certaines protéines situées à la surface des corps étrangers que l’on appelle « antigènes ». Lorsque l’organisme est en bonne santé, les antigènes déclenchent une réaction immunitaire qui détruit les agents pathogènes. Le système immunitaire peut alors protéger l’organisme non seulement des virus ou des bactéries, mais aussi de ses propres cellules pathologiquement modifiées. En effet, ces cellules sont porteuses d’antigènes modifiés à leur surface, que les cellules immunitaires identifient également comme étant « inconnus ». Dans le cas des cellules cancéreuses, les protéines sont appelées « antigènes cancéreux ».
Les cellules cancéreuses elles-mêmes constituent la première étape du processus de reconnaissance de la tumeur par le système immunitaire. En effet, ces cellules libèrent des antigènes cancéreux. Certaines cellules de notre système immunitaire capturent ces antigènes et les transportent dans les ganglions lymphatiques, où ils sont présentés aux cellules de défense directe de notre organisme: les lymphocytes T. À cette étape, il est essentiel que les lymphocytes T reconnaissent également les antigènes comme un danger. Si tel est le cas, les lymphocytes T sont activés :ils se multiplient et migrent vers la tumeur via la circulation sanguine. Ils repèrent les cellules cancéreuses à l’aide des antigènes cancéreux, les attaquent et dans le meilleur des cas, les détruisent. Cette réaction libère alors de nouveaux antigènes cancéreux, et ce cycle positif, appelé « cycle cancer-immunité » par les experts, recommence depuis la première étape. Idéalement, le processus d’auto-entretien se déroule naturellement, de façon à ce que l’organisme puisse se protéger lui-même des cellules mutées.
1) Les cellules cancéreuses libèrent des protéines spéciales, appelées antigènes tumoraux.
2) Les cellules immunitaires attaquent les antigènes tumoraux et les acheminent vers les cellules T dans les ganglions lymphatiques.
3) Si les cellules T reconnaissent les antigènes tumoraux comme étant étrangers, elles combattent le cancer.
4) Les cellules T migre vers le tissu tumoral en empruntant les vaisseaux sanguins.
5) Les lymphocytes T pénètrent dans le tissu tumoral.
6) Elles identifient les cellules cancéreuses à la présence d’antigènes.
7) Les cellules T déclenchent la destruction des cellules cancéreuses. De nouveaux antigènes tumoraux sont alors libérés et le cycle recommence.
Les cellules cancéreuses ont toutefois trouvé des moyens d’échapper au système immunitaire de l’organisme : elles produisent certaines protéines à la surface de leur cellule qui capturent et retiennent les lymphocytes T. Ceux-ci ne sont ainsi plus en mesure de reconnaître la cellule cancéreuse en tant que telle et sont désactivés. Les cellules cancéreuses, maintenant camouflées, échappent ainsi au système immunitaire et peuvent se multiplier sans entraves.
La liaison d’une protéine particulière à la cellule cancéreuse désactive le lymphocyte T.
Les cellules cancéreuses peuvent produire différentes protéines qui se lient aux lymphocytes T et inhibent ainsi le système immunitaire, par exemple les protéines PD-L1 ou CTLA-4. Pour déterminer le type de tumeur présente chez un patient, on teste les cellules cancéreuses pour identifier certaines protéines spécifiques qui sont associées à cette inhibition du système immunitaire.
Que sont les biomarqueurs ?
Un biomarqueur est une caractéristique biologique spécifique qui peut être mesurée objectivement et évaluée cliniquement. Il sert d’indicateur pour déterminer si un processus biologique dans l’organisme se déroule normalement ou de manière pathologique. Les biomarqueurs peuvent être des gènes, des produits génétiques, des protéines ou des hormones et font donc partie intégrante du profil génomique global de la tumeur. Les mesures de la pression artérielle ou de la glycémie sont les exemples les plus connus visant à déterminer les biomarqueurs. En oncologie, on utilise souvent des biomarqueurs génomiques appelés marqueurs cancéreux ou tumoraux. Ils indiquent les mutations ayant entraîné la formation d’une cellule cancéreuse à partir d’une cellule saine de l’organisme. Ces mutations peuvent également influer sur l’apparence et la texture de la surface des cellules. La modification peut par conséquent être étudiée non seulement au niveau génomique, mais aussi au niveau moléculaire et cellulaire.
Comment se déroulent les tests de biomarqueurs
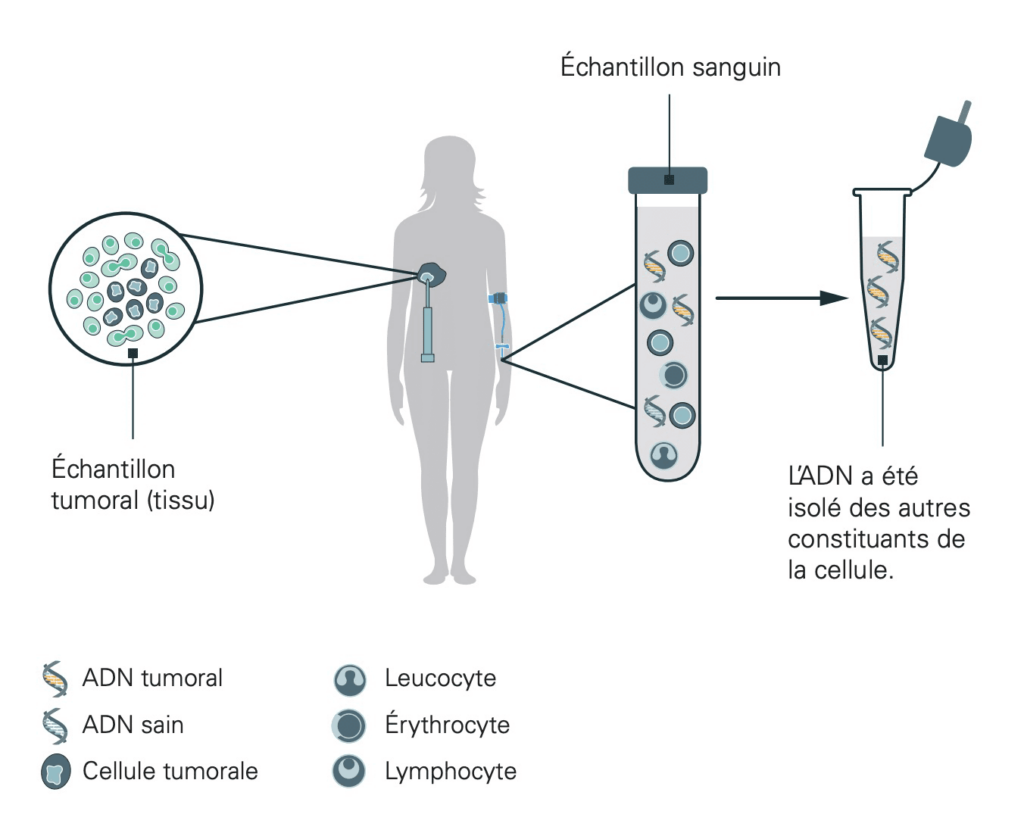
Un échantillon sera prélevé pour étudier la tumeur du patient.
Cet échantillon est testé pour des biomarqueurs prédéterminés, dont on sait qu’ils sont souvent modifiés dans le génome du type de cancer concerné. Les modifications génomiques exactes peuvent être analysées à l’aide du tissu tumoral.
Dans certaines conditions, l’analyse peut également être réalisée avec du sang, souvent plus facile à obtenir. Un test sanguin est par exemple réalisé dans les situations suivantes :
- l’échantillon tissulaire de la tumeur n’est plus suffisant pour réaliser des analyses.
- la tumeur a progressé et des métastases se sont disséminées dans l’organisme.
- la tumeur est localisée à un endroit difficile d’accès pour une biopsie.
Les tests de biomarqueurs sont très bénéfiques pour les patients atteints de cancer. Le concept de traitement personnalisé utilise diverses modifications génétiques en tant que biomarqueurs déterminés à l’aide d’un test à marqueur unique ou d’un profil tumoral complet, afin de permettre une prise en charge plus précise du traitement et un meilleur contrôle de la maladie.
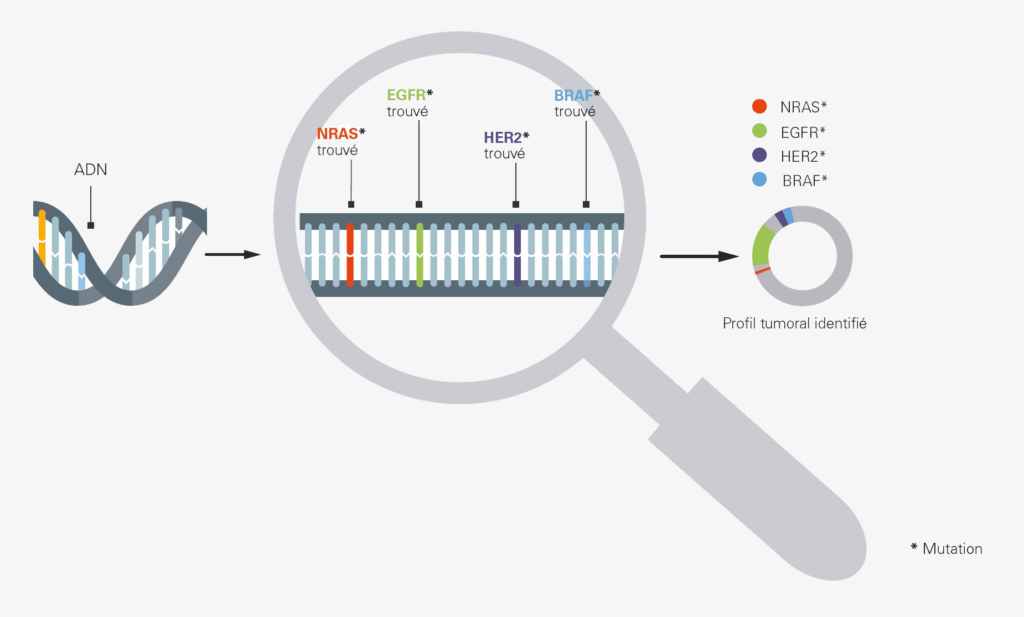
À l’heure actuelle, le type de test le plus fréquemment utilisé dans le diagnostic des tumeurs est le test à marqueur unique. Ce test porte spécifiquement sur une seule ou plusieurs modifications génétiques prédéterminées qui sont typiques d’un type de cancer spécifique.
Une analyse complète du génome tumoral, ce qu’on appelle un « profil tumoral complet », permet de rechercher, dans un seul échantillon de sang/tissu, tous les types de modifications génomiques de l’ensemble des gènes actuellement connus comme étant à l’origine d’un cancer. Cette analyse permet ainsi d’identifier des modifications qui sont plutôt rarement associées à une croissance dans un type de tumeur donné. Cela ouvre au médecin de nouvelles possibilités thérapeutiques et de nouvelles stratégies d’attaque potentielles, par exemple lorsqu’un patient n’a pas répondu à des traitements antérieurs. Plus la tumeur est étudiée de près, mieux le traitement peut être planifié : en effet, les données médicales sont la clé d’un traitement personnalisé.
En réalisant le test, le médecin peut éviter de recourir à un traitement inefficace, par exemple un traitement visant une modification génomique spécifique qui n’existe pas.
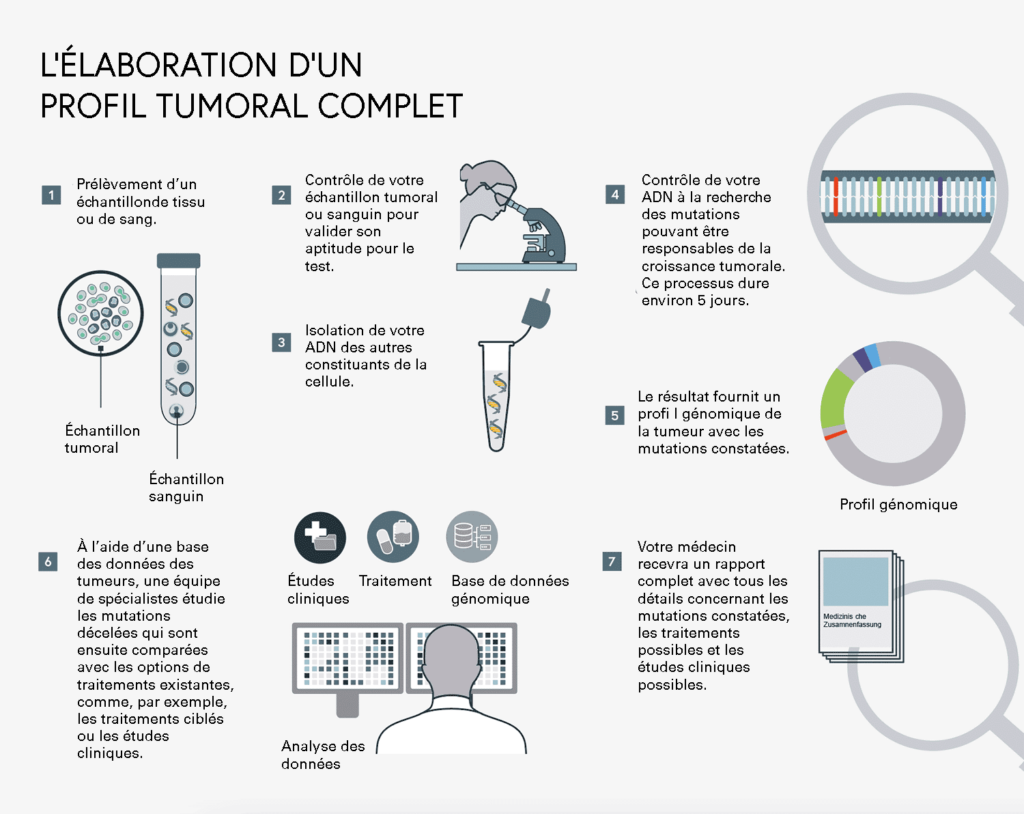
Le traitement développé spécialement pour une mutation donnée est utilisé si le test est positif, c’est-à-dire si la mutation recherchée est effectivement présente. Grâce à l’action ciblée du traitement, les processus de croissance des cellules cancéreuses sont idéalement inhibés ou supprimés.
Biomarqueurs spécifiques dans différents types de tumeurs
Le dépistage génomique n’est pas encore perfectionné et établi de la même manière pour tous les cancers. Les avancées sont déjà importantes pour certains types de cancer, tels que le cancer du sein et le cancer du poumon. Des travaux de recherche et développement doivent encore être entrepris pour d’autres types de cancer.
Exemple : cancer du sein
Les cellules saines du tissu glandulaire mammaire présentent des récepteurs hormonaux qui fixent les hormones sexuelles féminines : les œstrogènes et la progestérone. Les cellules tumorales présentent également ces récepteurs chez environ 70 à 80 % des patientes atteintes d’un cancer du sein. Le cancer du sein est alors qualifié de cancer « à récepteurs hormonaux positifs » (HR+). La prolifération des cellules est stimulée lorsque les œstrogènes ou la progestérone se fixent aux récepteurs et la tumeur croît de façon hormono-dépendante. Le cancer du sein est dit « à récepteurs hormonaux négatifs » (HR-) si les cellules tumorales ne présentent pas de récepteurs.
Le HER2 est un récepteur qui transmet des signaux de croissance de la surface cellulaire vers l’intérieur de la cellule. La quantité de HER2 peut être excessive au niveau des cellules du cancer du sein, qui émettent alors trop de signaux et stimulent ainsi la croissance tumorale. On parle alors de « cancer du sein HER2-positif ». Environ 14 % des patientes atteintes d’un cancer du sein en Suisse sont HER2-positives.
Les gènes BRCA1 ou BRCA2 sont modifiés dans environ la moitié des cas de cancer du sein avec prédisposition héréditaire. Ces gènes produisent des protéines qui permettent de réparer les dommages causés à l’ADN. Lorsqu’un gène BRCA a été muté, il est possible qu’il ne soit plus en mesure d’effectuer ces réparations et que les dommages à l’ADN s’accumulent. Ce processus favorise le développement du cancer du sein.
Exemple : cancer du poumon
De nombreuses mutations ont déjà été identifiées dans le type le plus fréquent de cancer du poumon, à savoir le cancer du poumon non à petites cellules. Les gènes appelés KRAS, EGFR, ALK et ROS1 sont particulièrement touchés. Lorsqu’une tumeur présente une modification au niveau de l’un de ces gènes, il est possible de la traiter de manière ciblée avec des médicaments appropriés. Les traitements ciblés restent inefficaces en l’absence de ces modifications : il n’est même pas nécessaire de les tester, ce qui évite aux personnes concernées des déceptions et des effets indésirables inutiles.
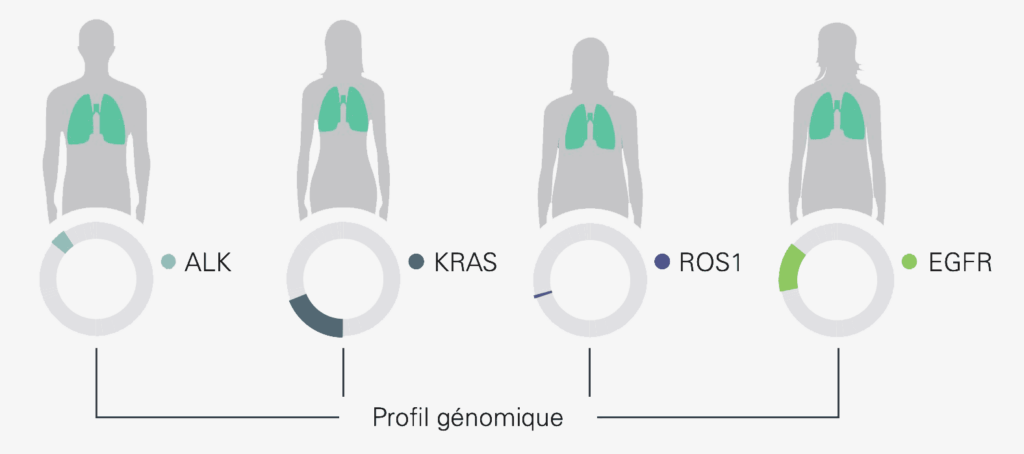
Exemple : biomarqueurs pertinents pour différentes tumeurs
De rares modifications génomiques, telles que la NTRK (récepteur tyrosine kinase neurotrophique) et la ROS1 (proto-oncogène ROS1), sont observées dans un grand nombre de tumeurs : il s’agit notamment des sarcomes, du cancer du sein triple négatif, des carcinomes de la tête et du cou, des glandes salivaires, de la vessie et des poumons.
Porteur d’espoir ou voie à sens unique ?
Même un profil tumoral complet ne garantit en rien de trouver un traitement adapté. Il n’existe pas encore de thérapie ciblée autorisée en Suisse pour certaines modifications génomiques qui entraînent une croissance tumorale excessive. Les résultats des tests permettent toutefois d’identifier les modifications génomiques correspondantes. Les patients pourront ainsi éventuellement participer à une étude appropriée dans le cadre de laquelle seront testés de nouveaux médicaments contre la mutation en cause.
Résumé
Les tests de biomarqueurs modifient le choix du traitement en cas de cancer et peuvent permettre de mettre en œuvre un traitement ciblé.