
Contenu
Du traitement standard au traitement ciblé
Les perspectives des patients se sont constamment améliorées au fil des ans. Le taux de mortalité dû au cancer a ainsi baissé de 23 pour cent depuis 1991. Les traitements ciblés sont de plus en plus importants : un traitement sur cinq nouvellement homologué chaque année est un traitement ciblé. Environ 50 pour cent de ces traitements sont des traitements anticancéreux.
Comment traiter une tumeur de façon ciblée ?
Chaque cancer est différent. C’est pourquoi il est impossible de traiter chaque cancer de la même manière : par exemple, deux patientes atteintes d’un cancer du sein sont traitées différemment, précisément en fonction des caractéristiques individuelles de leur tumeur. Ces traitements ciblés permettent de mettre en œuvre une médecine personnalisée, la médecine du futur.
Autrefois, le cancer était principalement traité par chimiothérapie. Ce type de traitement s’attaque à toutes les cellules de l’organisme qui se multiplient rapidement. Cela signifie qu’en plus des cellules cancéreuses, les cellules du tube digestif, des racines capillaires et du système immunitaire sont également visées. C’est pourquoi, pendant une chimiothérapie, les patients sont souvent confrontés à de graves effets indésirables, tels que nausées, chute des cheveux et immunodéficience.
Les informations génétiques de la tumeur doivent d’abord être soigneusement étudiées pour déterminer un traitement ciblé. Le médicament peut ensuite s’attaquer de manière ciblée aux propriétés de la tumeur à l’origine du cancer. Ce sont effectivement ses points faibles, car leur élimination signifie que la tumeur ne peut plus croître de manière incontrôlée. L’avantage est que l’on exploite les propriétés de la tumeur qui diffèrent des propriétés des cellules normales de l’organisme. Ainsi, on peut développer des médicaments spécifiques qui inhibent uniquement les cellules cancéreuses et non les cellules saines. Les traitements ciblés sont ainsi généralement mieux tolérés et plus efficaces que les traitements anticancéreux traditionnels.
Qu’est-ce qu’une immunothérapie anticancéreuse ?
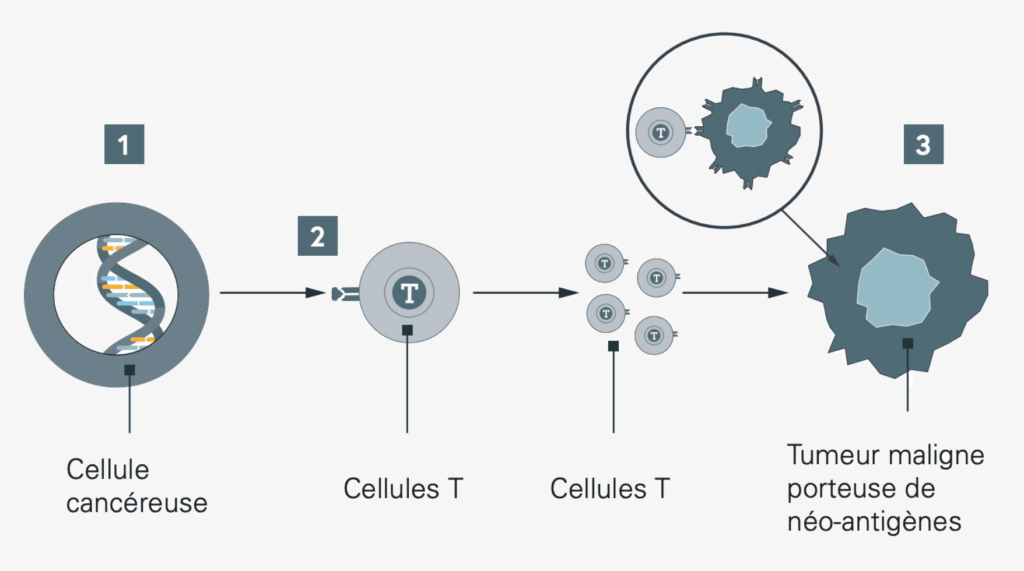
Le système immunitaire reconnaît dans la plupart des cas les modifications de nos cellules corporelles et élimine rapidement les cellules modifiées. Le système immunitaire de l’organisme peut donc être un partenaire important dans la lutte contre le cancer, si l’on est en mesure de l’activer de manière ciblée.
Notre système immunitaire « élimine » les cellules cancéreuses de façon très efficace. Certaines cellules cancéreuses ont toutefois trouvé des moyens d’échapper au système immunitaire de l’organisme : elles produisent des protéines spécifiques à leur surface et échappent ainsi au système immunitaire. Cependant, ce camouflage peut être annulé grâce à des médicaments : si des protéines de camouflage sont découvertes lors de l’analyse précise des caractéristiques de la tumeur, on peut rendre le cancer à nouveau visible au système immunitaire grâce à un traitement adapté. C’est comme si l’on desserrait le frein à main du système immunitaire : il reconnaît ainsi la tumeur et la combat efficacement.
En plus de se camoufler et d’échapper au système immunitaire, les cellules cancéreuses bloquent également la réaction du système immunitaire. Elles utilisent à cet effet ce qu’on appelle des « points de contrôle immunitaires ». Il s’agit de mécanismes de contrôle du système immunitaire permettant d’interrompre la réaction immunitaire. Certaines cellules cancéreuses sont passées maîtres dans l’art d’activer ces points de contrôle et de freiner ainsi la réaction immunitaire. En utilisant des inhibiteurs de point de contrôle, les points de contrôle activés par les cellules cancéreuses dans le système immunitaire sont ignorés, ce qui permet au système immunitaire de rester actif. Les cellules immunitaires de l’organisme peuvent à nouveau reconnaître et combattre les cellules cancéreuses.

Certaines tumeurs sont plus « sujettes aux mutations » que d’autres. Elles changent plus souvent et présentent par conséquent plus de mutations au fil du temps. Cette propriété de la tumeur est mesurée avec le taux de « charge mutationnelle tumorale », ou « TMB » (en anglais, Tumor Mutational Burden). Un taux de TMB élevé est souvent associé de manière plutôt positive à la réponse à une immunothérapie anticancéreuse. En effet, la cellule tumorale se distingue davantage d’une cellule normale à chaque modification, ce qui la rend plus facilement reconnaissable par le système immunitaire.
Questions fréquentes sur l’immunothérapie anticancéreuse
Dans quel contexte les immunothérapies seront-elles utilisées ?
L’immunothérapie par inhibiteurs de points de contrôle a jusqu’à présent été surtout utilisée à des stades avancés de diverses affections tumorales. Les progrès de la recherche permettent cependant d’utiliser parfois ces options thérapeutiques à des stades plus précoces.
Comment est administrée une immunothérapie anticancéreuse ?
L’administration s’effectue sous forme de perfusions et est donc effectuée chez le médecin ou à l’hôpital. Il s’agit le plus souvent d’un traitement ambulatoire, ce qui signifie qu’une hospitalisation de plusieurs jours n’est en règle générale pas nécessaire.
Comment le médecin contrôle-t-il l’efficacité du traitement ?
Des examens d’imagerie médicale (TDM ou IRM) sont pratiqués à intervalles réguliers dans le cadre d’une immunothérapie anticancéreuse. Il convient alors de déterminer si le traitement est efficace. Bon à savoir : le système immunitaire ayant parfois besoin d’un peu de temps pour faire son travail, il est possible que l’effet soit retardé. L’expérience du médecin est alors requise.
Quels sont les effets indésirables potentiels de l’immunothérapie anticancéreuse ?
L’immunothérapie anticancéreuse est en règle générale bien tolérée. Il faut toutefois veiller à ne pas trop stimuler le système immunitaire. Dans certaines circonstances, elle cible également les cellules saines ; on parle alors de « réaction auto-immune ». Les effets indésirables les plus fréquents sont facilement contrôlables. La fatigue, les éruptions cutanées, la fièvre, la perte d’appétit ou les nausées en font partie. Le médecin traitant fournit des informations détaillées et une assistance en cas d’effets indésirables.
Traitements ciblés dans différents types de tumeurs
Une tumeur dont on connaît les caractéristiques de façon précise peut être traitée de manière plus ciblée. C’est pourquoi la tumeur est attentivement étudiée avant le début du traitement et testée pour différents biomarqueurs. Le traitement est adapté et personnalisé en fonction des caractéristiques présentes dans la tumeur.
Exemple : cancer du sein
Il existe trois types de tumeurs dans le cas du cancer du sein : dans la plupart des cas, les cellules du cancer du sein sont plus sensibles aux hormones sexuelles féminines, telles que les œstrogènes ou la progestérone, que les cellules normales. Les traitements antihormonaux fonctionnent souvent très bien lorsque cela est le cas. Chez environ une patiente sur sept, le cancer du sein ne dépend toutefois pas des hormones sexuelles, mais d’un récepteur appelé « HER2 ». Il se lie aux signaux de croissance présents dans l’organisme et peut également être facilement inhibé par les médicaments. On parle de « cancer du sein triple négatif » si aucune des trois caractéristiques (dépendance aux œstrogènes, à la progestérone et à HER2) n’est présente dans la tumeur. Dans ce cas, il n’est souvent pas possible d’administrer des traitements spécifiques, c’est pourquoi ce type de cancer est traité par chimiothérapie classique.
Les gènes BRCA1 et BRCA2 sont les déclencheurs les plus fréquents des formes héréditaires du cancer du sein. Lorsqu’un gène BRCA est muté, les dommages causés à l’ADN peuvent ne plus être réparés aussi efficacement et s’accumulent. Cela favorise le développement du cancer du sein. Cependant, les cellules cancéreuses meurent si leur ADN présente trop de lésions. C’est pourquoi d’autres systèmes de réparation de l’ADN, comme le système PARP, sont essentiels à la survie des cellules cancéreuses. Les inhibiteurs de PARP exploitent ce processus en bloquant ce mécanisme réparateur à l’intérieur des cellules cancéreuses. Le traitement par un inhibiteur de PARP peut donc être envisagé pour les femmes présentant une mutation BRCA avérée.
Exemple : cancer du poumon
En ce qui concerne le cancer du poumon le plus fréquent, le cancer du poumon non à petites cellules, il existe déjà de nombreux traitements ciblés contre certaines modifications, notamment dans les gènes appelés KRAS, EGFR, ALK et ROS1. C’est pourquoi dans ce cas un diagnostic complet avec un test génomique de la tumeur est particulièrement important. La tumeur peut être attaquée de manière ciblée à l’aide du médicament approprié en présence de l’une de ces modifications. Il s’agit là d’une information précieuse pour la planification du traitement, même si aucune de ces mutations n’est décelée : en effet, grâce à cette information, les traitements non efficaces peuvent a priori être évités.
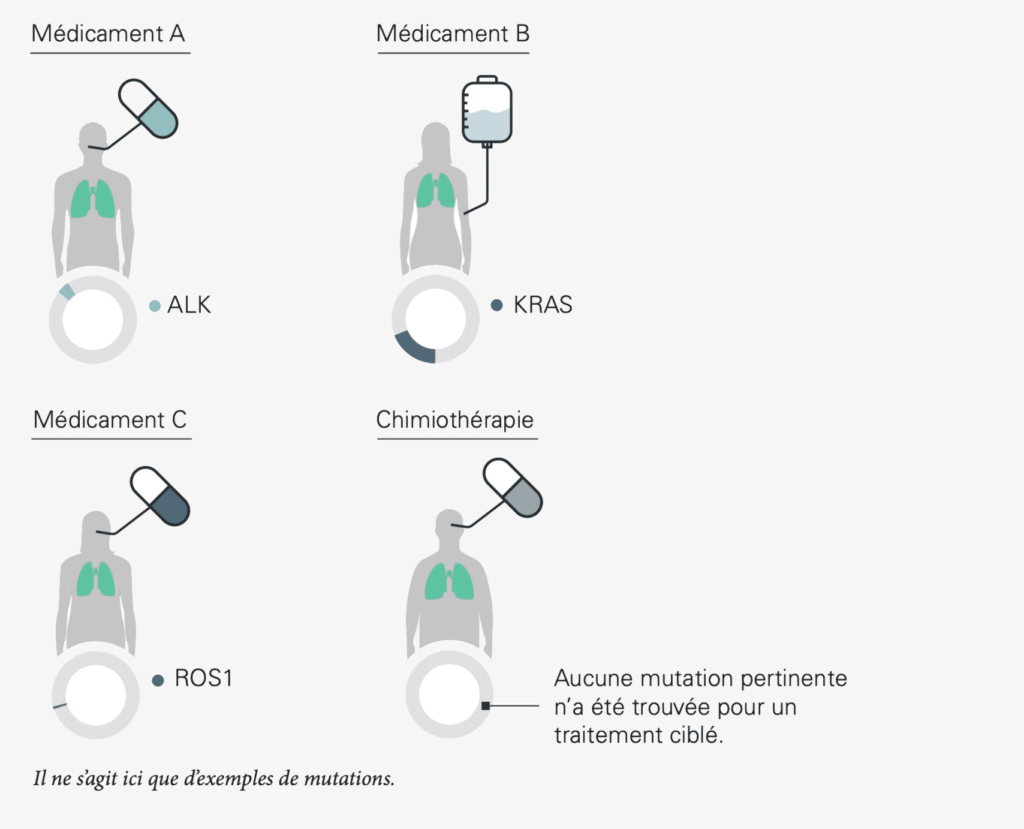
L’EGFR est un « site de fixation » pour les substances ayant un rôle de messagers à la surface des cellules, ce que l’on appelle un récepteur. La cellule reçoit davantage le signal de se diviser lorsqu’une substance messagère se fixe à l’EGFR modifié. La mutation génétique entraîne donc une croissance incontrôlée des cellules cancéreuses. Certains médicaments bloquent l’EGFR et empêchent ainsi la cellule cancéreuse de recevoir des signaux de croissance, ce qui freine la croissance incontrôlée. Ces principes actifs sont appelés « inhibiteurs de la tyrosine kinase de l’EGFR ». Un exemple en est le gène EGFR, qui présente des modifications génomiques chez 10 à 15 pour cent de tous les patients atteints de cancer du poumon non à petites cellules.
L’ALK est une forme particulière de mutation génétique, appelée « fusion de gènes ». Le gène ALK fusionne avec un autre gène et est alors appelé « fusion ALK ». Le gène est ainsi durablement actif, ce qui entraîne une croissance incontrôlée des cellules cancéreuses. Les médicaments ciblés utilisés dans ce cas sont des « inhibiteurs de l’ALK ».
Les mutations du gène ROS1 sont très rares. Elles sont également à l’origine d’une augmentation des signaux de croissance transmis par les cellules cancéreuses, qui se divisent alors de manière incontrôlée. Elles entraînent une multiplication des signaux de croissance envoyés par les cellules cancéreuses, qui se divisent alors de manière incontrôlée. Il existe également des traitements ciblés contre le cancer du poumon ROS1-positif.
Exemple : traitements ciblés visant plusieurs tumeurs
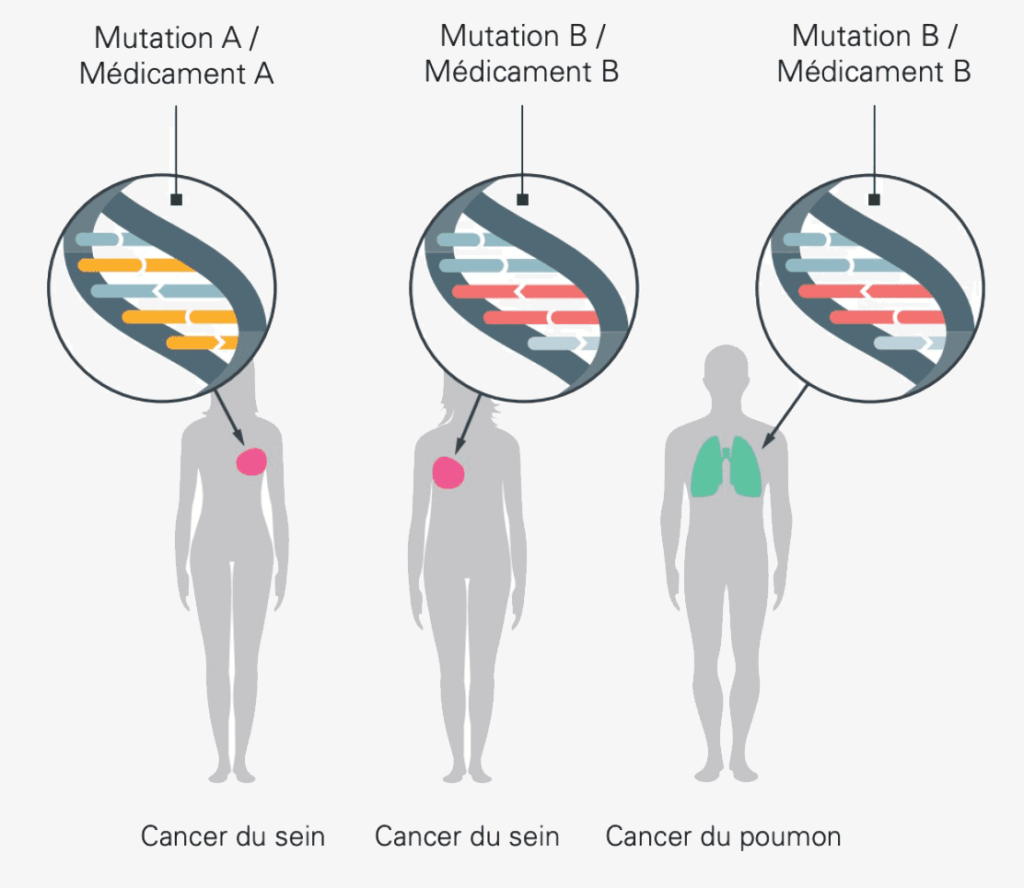
Les progrès de la recherche médicale permettent une compréhension toujours plus approfondie des affections cancéreuses et de la manière dont les modifications du patrimoine génétique de la tumeur les provoquent. On sait ainsi aujourd’hui que deux personnes atteintes d’un cancer apparemment identique (dans le cas d’un cancer du sein, par exemple) peuvent présenter des mutations totalement différentes dans leur ADN et doivent donc être traitées différemment. Inversement, deux personnes atteintes de tumeurs situées dans des organes différents peuvent cependant présenter les mêmes mutations. Un traitement similaire pourrait donc éventuellement être bénéfique chez ces deux personnes.
Les biomarqueurs non spécifiques des tumeurs sont par exemple des modifications génomiques rares telles que NTRK et ROS1. Ils sont importants, entre autres, dans les sarcomes, les cancers du sein triple négatifs, les cancers de la tête et du cou, des glandes salivaires, de la vessie et du poumon.
Les avancées se poursuivent
Des études indiquent qu’un traitement basé sur le profil génomique de la tumeur peut permettre d’obtenir de meilleurs résultats thérapeutiques dans de nombreux types de cancer. C’est pourquoi de nombreuses recherches sont menées dans ce domaine. Ainsi, la compréhension des mutations du cancer progresse et de nouveaux traitements anticancéreux ciblés peuvent en permanence être développés. L’objectif est de pouvoir proposer des traitements particulièrement bien tolérés et efficaces au plus grand nombre de patients.
Résumé
Les traitements ciblés ciblent spécifiquement les caractéristiques de la tumeur et aident le système immunitaire à reprendre sa lutte contre le cancer. Plus une tumeur est connue, plus son traitement peut être ciblé.
